Dịch Covid-19: Mỹ dừng sử dụng Evusheld, Việt Nam thế nào?
(Dân trí) - Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đề xuất tiếp tục cho phép lưu hành, sử dụng thuốc Evusheld tại Việt Nam.
Ngày 26/1, Cơ quan quản lý thực phẩm và dược phẩm Hoa Kỳ (USFDA) có thông báo tạm dừng cấp phép sử dụng trong trường hợp khẩn cấp thuốc Evusheld cho tới khi có thông báo cập nhật của USFDA. Lý do Evusheld không có tác dụng bảo vệ đối với một số biến chủng mới của SARS-CoV-2 hiện chiếm ưu thế tại Hoa Kỳ, như biến chủng phụ XBB.1.5 của Omicron (hiện có hơn 90% ca nhiễm do biến chủng này tại Hoa Kỳ).
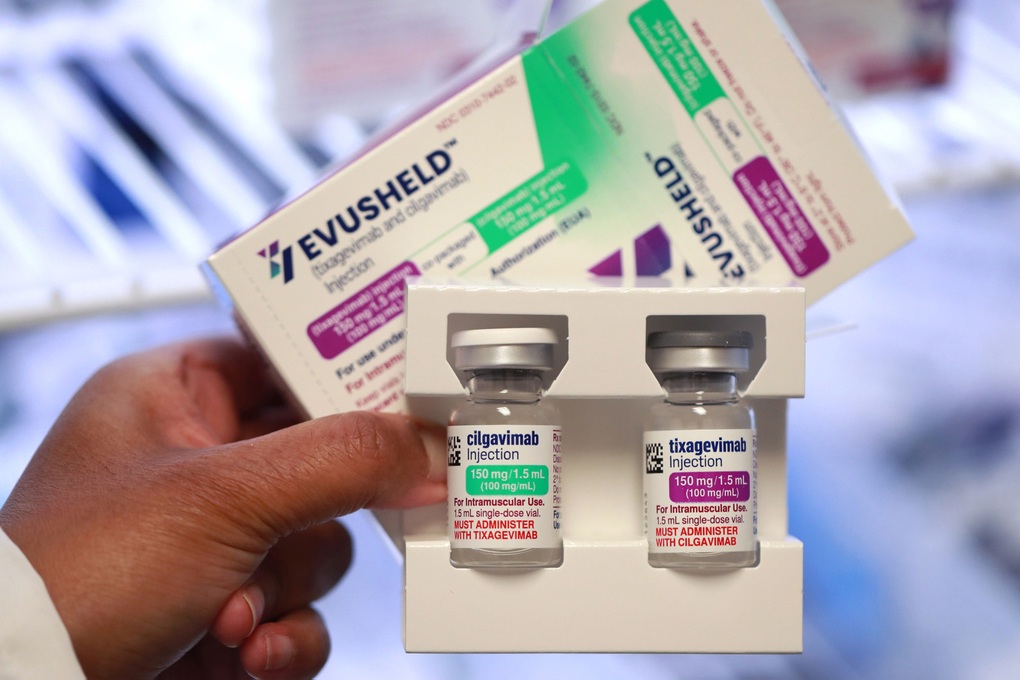
Ảnh minh họa: T. K.
Theo USFDA, việc sử dụng Evusheld sẽ bị giới hạn cho đến khi tỷ lệ biến chủng SARS-CoV-2 không nhạy cảm với Evusheld ở Hoa Kỳ giảm xuống dưới 90%.
Ngoài ra, USFDA khuyến cáo các cơ sở y tế và nhà cung cấp Evusheld vẫn nên giữ lại các chế phẩm hiện có để bảo quản theo quy định và sử dụng trong trường hợp các biến chủng của SARS-CoV-2 mà Evusheld chống lại được trở nên phổ biến hơn ở Hoa Kỳ.
Evusheld là sinh phẩm kết hợp bộ đôi kháng thể đơn dòng (tixagevimab 150mg/1,5ml và cilgavimab 150mg/1,5ml) được AstraZeneca phát triển. Nó được chỉ định dự phòng trước phơi nhiễm Covid-19 ở người lớn, thanh thiếu niên từ 12 tuổi trở lên có trọng lượng ít nhất 40kg.
Ngay sau khi nhận được thông tin trên từ USFDA, Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc của Bộ Y tế đã tổ chức họp khẩn cấp vào ngày 31/1 để xem xét về việc lưu hành, sử dụng thuốc Evusheld tại Việt Nam.
Trên cơ sở báo cáo, thông tin về các biến chủng của virus SARS-CoV-2 đang lưu hành tại Việt Nam, tình hình cấp phép, sử dụng Evusheld trên thế giới, cảnh báo của Tổ chức Y tế Thế giới (WHO) về đại dịch Covid-19 Hội đồng đã kết luận như sau:
Thứ nhất, biến chủng XBB của Omicron tại châu Á hiện chỉ chiếm khoảng 2-5% các trường hợp nhiễm SARS-CoV-2 và tỷ lệ này hiện nay của Việt Nam khoảng 3%.
Thứ 2, thuốc Evusheld hiện vẫn có tác dụng đối với các biến chủng của virus SARS-CoV-2 đang lưu hành phổ biến tại Việt Nam.
Cụ thể, tại miền Bắc trong 541 mẫu thực hiện giải trình tự gen tại Viện Vệ sinh dịch tễ Trung ương, từ tháng 6-11, biến thể BA5 chiếm ưu thế.
Thứ 3, ngoại trừ USFDA dừng cấp phép sử dụng, Evusheld vẫn đang được cho phép lưu hành, sử dụng bởi các EMA, Nhật Bản, Anh, Úc, Canada, Thụy Sĩ… và nhiều cơ quan quản lý dược trên thế giới.
Vì vậy, trên cơ sở phân tích tác dụng của thuốc với các biến chủng lưu hành tại Việt Nam và việc lưu hành, sử dụng thuốc tại các nước trên thế giới, Hội đồng thống nhất đề xuất tiếp tục cho phép lưu hành, sử dụng thuốc Evusheld tại Việt Nam. Đồng thời tiếp tục theo dõi, giám sát chặt chẽ và cập nhật thông tin về tính an toàn, hiệu quả của thuốc đối với các biến chủng của virus SARS-CoV-2 tại các nước trên thế giới và Việt Nam.
Evusheld đã được cấp phép lưu hành bởi nhiều cơ quan quản lý. Hiện Evusheld đã được sử dụng tại gần 40 quốc gia trên thế giới với chỉ định điều trị và/hoặc dự phòng phơi nhiễm Covid-19. Tại Việt Nam, thuốc Evusheld đã được cấp giấy đăng ký lưu hành ngày 25/10/2022.
Đến ngày 30/1, Evusheld vẫn được cho phép lưu hành, sử dụng bởi các cơ quan quản lý dược chặt chẽ (SRA) như EMA, Nhật Bản, Anh, Úc, Canada, Thụy Sĩ… và tại các nước khu vực châu Á như: Nhật Bản, Hồng Kông, Malaysia, Thái Lan, Singapore, Đài Loan.