Sửa luật Dược để người dân tiếp cận thuốc mới nhanh hơn
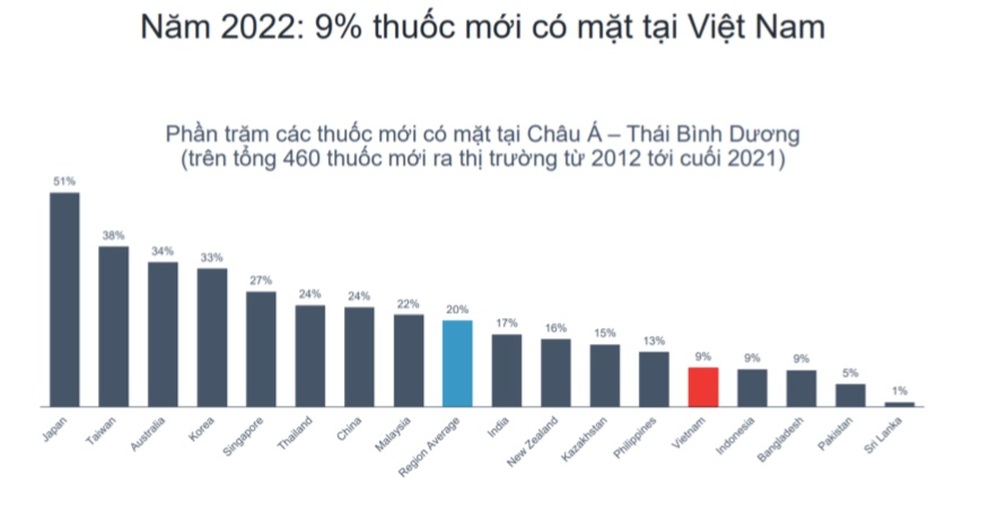
(Dân trí) - Hiện chỉ 9% thuốc mới có mặt ở Việt Nam trong vòng 10 năm (2012-2021), thấp hơn mức 20% của khu vực châu Á Thái Bình Dương. Vì thế, việc sửa luật Dược được kỳ vọng sẽ tăng tiếp cận thuốc phát minh.
Đơn giản hóa thủ tục đăng ký thuốc
Dự thảo sửa đổi bổ sung một số điều của luật Dược 2016 dự kiến trình Quốc hội vào kỳ họp tới đây.
Theo ông Chu Đăng Trung, Trưởng phòng pháp chế - hội nhập, Cục Quản lý Dược (Bộ Y tế), một trong những điểm mới của dự thảo là đơn giản hóa thủ tục hành chính về trình tự, thủ tục cấp giấy đăng ký lưu hành thuốc; tăng cường việc thừa nhận, công nhận nhằm tạo điều kiện thông thoáng, tăng tính chủ động cho doanh nghiệp.
Trong dự thảo cũng đề cập đến chính sách tạo điều kiện về thủ tục, trình tự nộp đơn đăng ký lưu hành thuốc mới, thuốc phát minh, thuốc biệt dược gốc, thuốc chuyên khoa đặc trị, ứng dụng công nghệ cao...
Đồng thời, dự thảo bước đầu quy định về cơ chế tham chiếu trong đăng ký lưu hành.
Đây là công cụ được nhiều nước trên thế giới triển khai trong nhiều năm vừa qua, nhằm hỗ trợ hiệu quả cho công tác quản lý nhà nước. Nó giúp rút ngắn thời gian thẩm định qua việc sử dụng báo cáo kết quả thẩm định của các cơ quan quản lý dược chặt chẽ, đáng tin cậy.
Các chuyên gia kỳ vọng, nhờ đó người dân có cơ hội tiếp cận thuốc mới ngang bằng hay nhanh hơn khu vực. Một số sản phẩm mới chỉ mất 4-10 tháng đã có mặt ở các nước như Singapore hay Philippines (nhờ vào cơ chế tham chiếu), trong khi ở Việt Nam phải mất gần 2 năm.
Việc đẩy nhanh đăng ký thuốc cũng tạo động lực cho các công ty dược phẩm ưu tiên đưa các thuốc mới về Việt Nam. Đồng thời, hạn chế đứt gãy nguồn cung ứng thuốc trên thị trường, tránh nguy cơ thiếu thuốc như đã từng xảy ra.
Trong khi đó, vẫn đảm bảo hiệu lực quản lý nhà nước về chất lượng, an toàn, hiệu quả của thuốc cho người dân.
Việc ban hành luật Dược sửa đổi bổ sung với nội dung hiện tại, trước mắt sẽ giải quyết nguy cơ đứt gãy nguồn cung liên quan đến các thủ tục đăng ký thuốc. Về lâu dài, điều này sẽ tăng sự tiếp cận thuốc phát minh, chất lượng hàng đầu thế giới và tạo điều kiện phát triển ngành dược phẩm Việt Nam.
Bên cạnh đó, một số ý kiến cũng đề xuất Bộ Y tế cần có kế hoạch chuyển tiếp rõ ràng để áp dụng theo quy định mới, đảm bảo không có khoảng trống pháp lý sau ngày 31/12/2024 đối với các thuốc đang đợi gia hạn theo luật hiện hành.
Đây là thời điểm thuốc, nguyên liệu làm thuốc trong nước và nước ngoài có giấy đăng ký lưu hành được tiếp tục sử dụng theo quy định tại khoản 1 điều 3 nghị quyết số 80/2023/QH15 hết hiệu lực. Điều này nhằm tránh gây thiếu thuốc phòng và trị bệnh.
Bên cạnh đó, cần đảm bảo các văn bản dưới luật được sửa đổi, ban hành đúng thời gian để không có khoảng trống pháp lý trong quá trình triển khai.
Đẩy mạnh phát triển công nghiệp dược trong nước
Theo ông Trung, dự thảo luật sửa đổi này cũng có nhiều ưu đãi mang tính đột phá so với luật Dược 2016 để đẩy mạnh phát triển công nghiệp dược.
Cụ thể, các lĩnh vực ưu tiên phát triển gồm: Nghiên cứu phát triển công nghệ, sản xuất hoặc chuyển giao công nghệ để sản xuất, thuốc mới hoặc biệt dược gốc, thuốc hiếm, thuốc generic đầu tiên, thuốc công nghệ cao, vaccine và sinh phẩm…
Dự thảo cũng nêu rõ các chính sách, hình thức và mức độ ưu đãi (quy định các dự án được hưởng chính sách ưu đãi và hỗ trợ đầu tư, các dự án được ưu đãi và hỗ trợ đầu tư đặc biệt sản xuất thuốc mới, thuốc phát minh, thuốc biệt dược gốc…).
Bên cạnh đó, dự thảo còn mở rộng quyền kinh doanh cho các cơ sở kinh doanh dược có vốn đầu tư nước ngoài (FIE) tại Việt Nam.
Trong đó, cho phép các doanh nghiệp này được trực tiếp phân phối các thuốc do chính doanh nghiệp sản xuất, đặt gia công, chuyển giao công nghệ tại Việt Nam. Từ đó, thu hút doanh nghiệp FIE đầu tư vào lĩnh vực này để nâng cao năng lực sản xuất trong nước.
Các chuyên gia cho rằng ngoài luật Dược sửa đổi, để thu hút đầu tư FDI, đặc biệt vào ngành dược phẩm giá trị cao sẽ cần có thêm những chính sách ưu đãi riêng biệt, rõ nét, vượt trội trong bối cảnh cạnh tranh mạnh mẽ trong khu vực hiện nay.
Điều này đặt trách nhiệm lên Ban chỉ đạo quốc gia Phát triển ngành Dược tiếp tục đưa ra các chiến lược phát triển ngành phù hợp từng thời điểm và xu hướng trên thế giới, liên tục theo dõi, đánh giá công tác thi hành chính sách phát triển ngành và phản hồi thực tế từ các doanh nghiệp, nhà đầu tư.
Việt Nam đặt mục tiêu vào năm 2030 trở thành trung tâm sản xuất dược phẩm giá trị cao trong khu vực. Cụ thể, phấn đấu giá trị xuất khẩu thuốc sản xuất trong nước đạt khoảng 1 tỷ USD vào năm 2030 và 20 tỷ USD vào năm 2045 (thống kê hiện tại là dưới 200 triệu USD).
Đồng thời, tiếp nhận chuyển giao công nghệ, gia công có phối hợp chuyển giao công nghệ sản xuất ít nhất 100 thuốc biệt dược gốc, vaccine, sinh phẩm bao gồm cả sinh phẩm tương tự và một số thuốc mà Việt Nam chưa sản xuất được (thống kê hiện tại dưới 20 thuốc).