Thu hồi đăng ký lưu hành 4 loại thuốc
(Dân trí) - Cục Quản lý Dược (Bộ Y tế) vừa ban hành quyết định thu hồi Giấy đăng ký lưu hành 4 loại thuốc.
Cụ thể 4 thuốc thu hồi đăng ký lưu hành tại Việt Nam gồm:
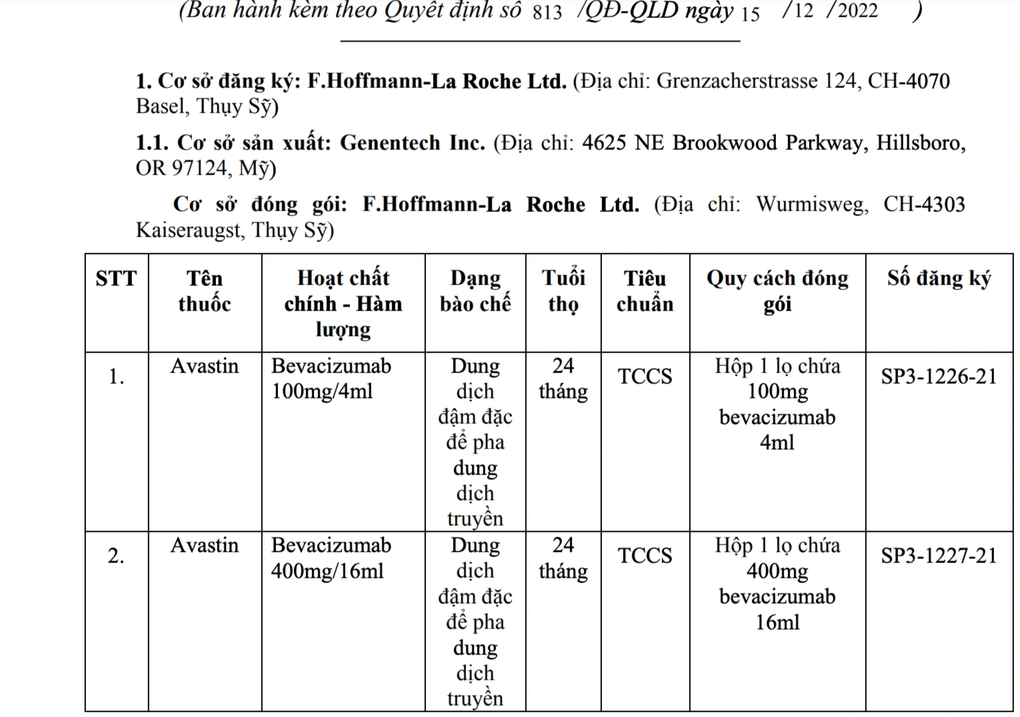
Cơ sở đăng ký: F.Hoffmann-La Roche Ltd. (Địa chỉ: Grenzacherstrasse 124, CH-4070 Basel, Thụy Sỹ); Cơ sở sản xuất: Genentech Inc. (Địa chỉ: 4625 NE Brookwood Parkway, Hillsboro, OR 97124, Mỹ): Cơ sở đóng gói: F.Hoffmann-La Roche Ltd. (Địa chỉ: Wurmisweg, CH-4303 Kaiseraugst, Thụy Sỹ).
Hai thuốc bị thu hồi Giấy đăng ký lưu hành gồm thuốc Avastin Bevacizumab 100mg/4ml, dung dịch đậm đặc để pha dung dịch truyền, hạn sử dụng 24 tháng và thuốc Avastin Bevacizumab 400mg/16ml, dung dịch đậm đặc để pha dung dịch truyền hạn sử dụng 24 tháng.
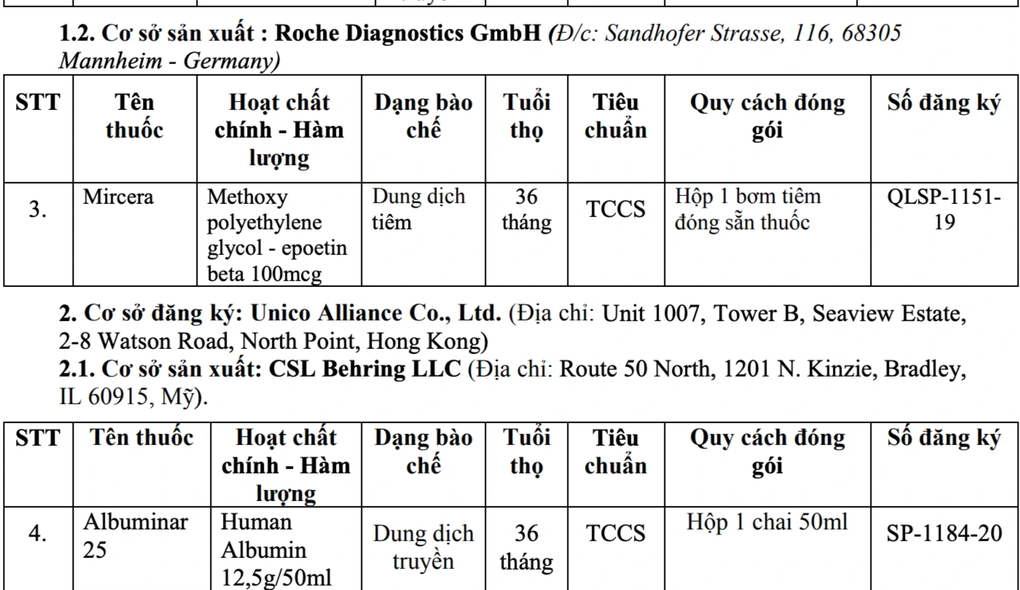
Cơ sở sản xuất: Roche Diagnostics GmbH (Đ/c: Sandhofer Strasse, 116, 68305 Mannheim - Germany) với loại thuốc Mircera Methoxy polyethylene glycol - epoetin beta 100mcg, dung dịch tiêm, hạn sử dụng 36 tháng.
Cơ sở đăng ký: Unico Alliance Co., Ltd. (Địa chỉ: Unit 1007, Tower B, Seaview Estate, 2-8 Watson Road, North Point, Hong Kong); Cơ sở sản xuất: CSL Behring LLC (Địa chỉ: Route 50 North, 1201 N. Kinzie, Bradley, IL 60915, Mỹ) với loại thuốc Albuminar 25 Human Albumin 12,5g/50ml, dung dịch truyền, hạn sử dụng 36 tháng.
Ngày 15/12, Cục Quản lý Dược ra quyết định thu hồi Giấy đăng ký lưu hành thuốc tại Việt Nam đối với 4 thuốc có tên trên, lý do vì cơ sở sản xuất hoặc cơ sở đăng ký thuốc, nguyên liệu làm thuốc đề nghị thu hồi giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc tại Việt Nam.
Các loại thuốc trên được sản xuất trước ngày quyết định có hiệu lực và đã nhập khẩu vào Việt Nam; hoặc thuốc nước ngoài nhập khẩu trong trường hợp được giao hàng tại cảng đi của nước xuất khẩu trước ngày quyết định này có hiệu lực tiếp tục được phép lưu hành đến hết hạn dùng của thuốc.
Cục Quản lý Dược đề nghị cơ sở đăng ký thuốc, sản xuất thuốc phải có trách nhiệm theo dõi và chịu trách nhiệm về chất lượng, an toàn, hiệu quả của thuốc trong quá trình lưu hành.