Sở Y tế Bình Định thu hồi 11 thuốc chứa tạp chất có nguy cơ gây ung thư
(Dân trí) - Ngày 12/10, tin từ Sở Y tế Bình Định cho biết đã yêu cầu các đơn vị trực thuộc, doanh nghiệp bán buôn thuốc và phòng Y tế huyện, thị xã, thành phố thu hồi 11 loại thuốc chứa Ranitidine có chứa tạp chất chất N-nitrosodimethylamine (NDMA) vượt giới hạn cho phép.
Trước đó, Cơ quan Khoa học y tế Singapore (HSA), Cơ quan quản lý dược phẩm Thụy Sĩ (Swissmedic) có thông báo về việc thu hồi các thuốc chứa Ranitidine do phát hiện chứa tạp chất N-nitrosodimethylamine (NDMA) có nguy cơ gây ung thư ở hàm lượng vượt quá ngưỡng cho phép của quốc tế.
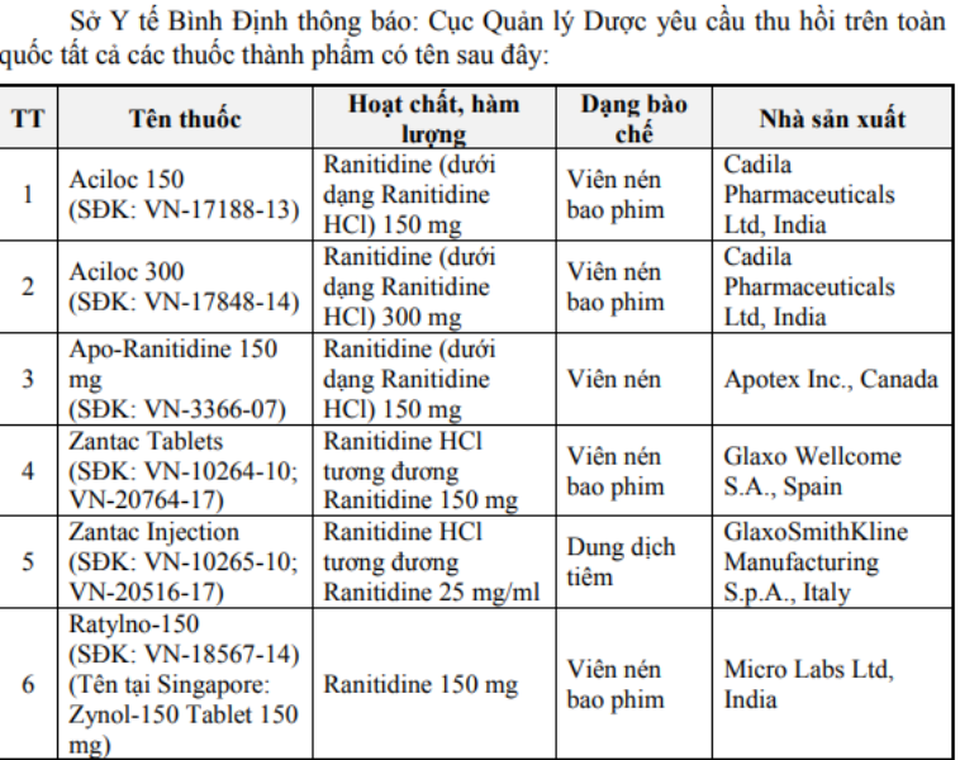
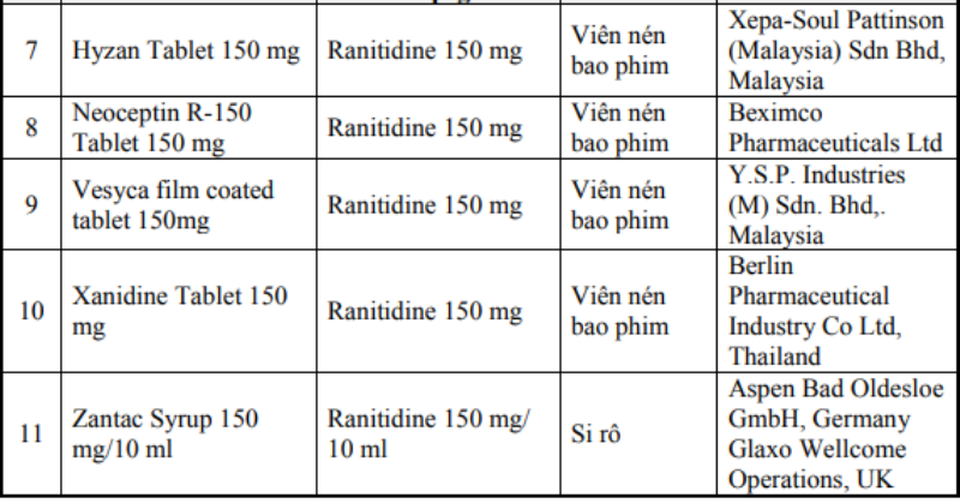
Theo đó, 11 thuốc bị Cục Quản lý Dược thu hồi có hàm lượng Ranitidine 150 mg/10ml, 150 mg/25 ml và 150 mg, xuất xứ từ Ấn Độ, Tây Ban Nha, Italy, Anh, Thái Lan, Malaysia. Cụ thể là Aciloc 150 mg, Aciloc 300 mg, Apro-Ranitidine 150 mg, Zantac Tablets, Zantac Injection, Ratylno-150, Hyzan Tablet 150 mg, Neoceptin R-150 Tablet 150 mg, Vesyca film coated tablet 150 mg, Xanidine Tablet 150 mg, Zantac Syrup 150 mg/10 ml.
Ranitidine là thành phần chính trong các thuốc chữa dạ dày và ruột.
Sở Y tế Bình Định yêu cầu các đơn vị trực thuộc thông báo đến các bộ phận thuộc quyền; các doanh nghiệp bán buôn thuốc thông báo cho các cơ sở bán lẻ trực thuộc; Phòng Y tế huyện, thị xã, thành phố thông báo đến các cơ sở hành nghề y, dược tư nhân trên địa bàn để thu hồi thuốc các thuốc nêu trên (nếu có sử dụng, kinh doanh) trả lại nơi cung ứng, đảm bảo các thuốc nêu trên không còn lưu thông trên thị trường trong phạm vi toàn tỉnh.
Thu hồi 2 loại thuốc không đạt tiêu chuẩn chất lượng
Sở Y tế Bình Định cũng cho biết, cơ quan này vừa yêu cầu các đơn vị trực thuộc, doanh nghiệp bán buôn thuốc và phòng Y tế tuyến huyện thu hồi toàn bộ 2 lô thuốc Desratel (Desloratadin 5mg) và thuốc Cetirizin (Cetirizine 2HCL 10mg) không đạt tiêu chuẩn chất lượng, theo thông báo của Cục Quản lý Dược (Bộ Y tế).
Đó là lô thuốc viên nén dài bao phim Cetirizin (Cetirizine 2HCl 10mg), SĐK: VD-19303-13, số lô 002171, hạn dùng 14/4/2020, do Công ty CP Dược phẩm 3/2 sản xuất, không đạt tiêu chuẩn chất lượng về chỉ tiêu độ hòa tan (vi phạm mức độ 3). Đây là thuốc kháng histamin mạnh có tác dụng chống dị ứng, thường được sử dụng để điều trị tình trạng ngứa và sưng do viêm mũi dị ứng kéo dài và theo mùa, cảm lạnh, nổi mày đay, phù mạch, phản ứng phản vệ, ngứa, viêm kết mạc dị ứng.
Thuốc viên nén bao phim Desrated (Desloratadin 5mg), SĐK: VD-28452-17, số lô 190157, hạn sử dụng 19/2/2022, do Công ty CP Dược phẩm Đạt Vi Phú sản xuất, không đạt tiêu chuẩn chất lượng về chỉ tiêu định lượng (vi phạm mức độ 2).
Desrated sử dụng trong giảm các triệu chứng viêm mũi dị ứng theo mùa, viêm mũi dị ứng quanh năm như hắt hơi, sổ mũi, ngứa, nghẹt mũi, kèm kích ứng mắt, giảm các triệu chứng mày đay mạn tính tự phát.
Doãn Công