Đâu là những vắc xin ứng viên kháng SARS-CoV-2 tiềm năng hiện nay?
(Dân trí) - Sử dụng vật liệu từ các virus gây cảm lạnh đã bị làm yếu đi cho đến các đoạn mã di truyền, các nhà khoa học trên khắp thế giới đang tạo ra hàng chục ứng viên vắc xin khác nhau để chống lại SARS-CoV-2.
Và họ đang làm công việc này với nỗ lực vượt bậc về tốc độ chưa từng có từ trước đến nay.
Hơn 7 tháng sau khi Tổ chức Y tế thế giới (WHO) cảnh báo lần đầu tiên về một nhóm trường hợp viêm phổi bí ẩn ở Vũ Hán, Trung Quốc, đến nay đã có 167 ứng viên vắc xin đang được phát triển nhằm mục tiêu phòng ngừa SARS-CoV-2 gây bệnh Covid-19. Hầu hết các ứng viên vắc xin này đang trong giai đoạn tiền lâm sàng, tức là vẫn đang được thử nghiệm trên động vật hoạt trong phòng thí nghiệm, chỉ một số ít đã chuyển sang thử nghiệm trên cơ thể người.
Theo Cục Quản lý Thực phẩm và Dược phẩm Mỹ (FDA), thử nghiệm lâm sàng trên người được chia làm ba hoặc bốn giai đoạn, với những giai đoạn đầu là để kiểm tra tính an toàn, liều lượng và tác dụng phụ có thể có cùng với hiệu quả (tức là vắc xin có tác dụng chống lại mầm bệnh đến mức nào) của các vắc xin ứng viên trong một nhóm ít người. Tuy nhiên, điểm mấu chốt để một vắc xin ứng viên được phê duyệt là nó phải có tiềm năng mang lại kết quả khả quan ở giai đoạn thử nghiệm thứ ba.
Trong các thử nghiệm ở giai đoạn ba, các nhà nghiên cứu kiểm tra hiệu quả của vắc xin đồng thời giám sát các phản ứng phụ nếu có ở hàng trăm nghìn người tình nguyện thử nghiệm. Sau đó FDA sẽ phê duyệt vắc xin này nếu các đợt thử nghiệm cho thấy vắc xin an toàn và hiệu quả, các lợi ích mà vắc xin mang lại lớn hơn nhiều so với những rủi ro nó có thể gây ra. WHO cho biết hiện có 5 vắc xin phòng ngừa virus corona mới đã bắt đầu đi vào giai đoạn ba. Dưới đây là những ứng viên vắc xin có tiềm năng nhất.
Trường đại học Oxford/ Công ty AstraZeneca
Vắc xin này hiện được đặt tên là ChAdOx1 nCoV-19, thường được gọi là vắc xin Oxford, do Trường đại học Anh phối hợp với Công ty dược phẩm và dược phẩm sinh học AstraZeneca phát triển. Vắc xin này được tạo ra từ virus cảm lạnh thông thường đã được làm yếu đi (virus adeno) và gây bệnh cho tinh tinh.
Các nhà nghiên cứu đã làm biến đổi di truyền của virus này để nó không thể nhân bản ở người và bổ sung một số gene vào mã của protein dằm mà virus corona dùng để xâm nhập vào tế bào của người. Về lý thuyết, vắc xin này sẽ bảo cho cơ thể cách nhận ra các dằm của virus corona, nhờ đó khi một người phơi nhiễm, hệ miễn dịch của người đó có thể tiêu diệt virus.
Trước đó các nhà nghiên cứu đã thí nghiệm vắc xin này trên khỉ vàng (rhesus macaque monkey) và nhận thấy vắc xin này không ngăn được những con khỉ khỏi bị nhiễm virus khi chúng phơi nhiễm, nhưng vẫn giúp cho chúng không bị viêm phổi. Điều này cho thấy vắc xin phần nào có tác dụng bảo vệ.
Vào tháng 4/2020, các nhà nghiên cứu bắt đầu thí nghiệm vắc xin này trên người và sớm công bố vào ngày 20/7 các kết quả của giai đoạn 1 đã hoàn thành và giai đoạn 2 đang tiếp tục triển khai. Vắc xin này không gây ra bất cứ tác dụng phụ nghiêm trọng nào ở những người tham gia thí nghiệm nhưng có dấu hiệu gây ra một số tác dụng phụ nhẹ, như là đau cơ và cảm giác ớn lạnh.
Vắc xin đã thúc đẩy hệ miễn dịch sinh ra các tế bào T đặc hiệu chống lại SARS-CoV-2 (tế bào T là tế bào máu trắng rất quan trọng để chống lại mầm bệnh) và các kháng thể trung hòa, hay chính là các phân tử có thể bám vào virus và không cho virus tấn công tế bào.
Các thử nghiệm giai đoạn ba đã bắt đầu được thực hiện ở Brazil và sẽ có 5.000 người tình nguyện tham gia. Một thử nghiệm khác cũng thuộc giai đoạn ba dự kiến sẽ có thêm 10.500 người ở Anh và 30.000 người ở Mỹ tham gia.
Nhóm chuyên gia ở Oxford cũng cho biết họ quan tâm đến việc tiến hành các nghiên cứu khó hơn trên cơ thể người, tức là những người tình nguyện ít rủi ro sẽ được cho lây nhiễm virus một cách cẩn trọng. Nghiên cứu đầy thách thức này sẽ được tiến hành cùng hoặc sau khi hoàn thành các thử nghiệm của giai đoạn 3.
Bộ Y tế và Dịch vụ Nhân sinh Mỹ (HHS) đã công bố sẽ chi đến 1,2 tỷ đô-la Mỹ cho công ty AstraZeneca để đẩy nhanh quá trình phát triển vắc xin này và để giúp công ty điều chế ít nhất 300 triệu liều vắc xin vào tháng 10/2020, nếu như kết quả thử nghiệm cho thấy vắc xin này an toàn và hiệu quả.
SARS-CoV-2 sử dụng các protein dằm (như trong ảnh) để xâm nhập tế bào con người.
Sinovac Biotech
Một vắc xin ứng viên khác có tên PiCoVacc đang được Công ty dược phẩm sinh học Sinovac Biotech của Trung Quốc phát triển. Theo một nghiên cứu đã được công bố trên tạp chí Khoa học vào ngày 3/7/2020, vắc xin này có thể bảo vệ khỉ vàng khỏi nhiễm virus corona mới.
Sinova Biotech đã chứng minh vắc xin này an toàn và hiệu quả trong các thử nghiệm lâm sàng ban đầu, và hiện đang tiến hành thử nghiệm lâm sàng giai đoạn ba đối với 8.870 người ở Brazil.
HHS cho biết vắc xin này được tạo ra từ phiên bản virus SARS-CoV-2 đã bị khử hoạt tính. Các vắc xin dạng này chính là phiên bản đã chết của mầm bệnh (đối lập với các vắc xin sống chứa virus đã bị làm yếu đi).
Các virus đã bị khử hoạt tính như là vắc xin cúm hay vắc xin viêm gan A thường không có tác dụng bảo vệ mạnh như các vắc xin sống và có thể cần tiêm nhắc lại. Ngược lại, vắc xin Oxford là vắc xin sống, có thể tạo ra phản ứng miễn dịch lâu dài nhưng lại có xu hướng rủi ro hơn cho những ai có hệ miễn dịch yếu hoặc có các vấn đề khác về sức khỏe.
Sinovac bắc đầu các thử nghiệm giai đoạn 1 và 2 (trên 743 người lớn khỏe mạnh) vào tháng 4/2020 ở tỉnh Giang Tô, Trung Quốc. Những người tham gia được tiêm 2 liều vắc xin cách nhau 2 tuần và cho biết vắc xin không gây ra bất cứ tác dụng phụ nghiêm trọng nào.
Các nhà nghiên cứu vắc xin này cũng nói rằng hơn 90% người tham gia đã phát triển kháng thể trung hòa đối với vắc xin sau 2 tuần tiêm lần thứ hai. Tuy nhiên, những kết quả này mới chỉ được báo cáo qua một thông cáo báo chí và vẫn chưa được công bố trên tạp chí chuyên môn nào.
Công ty Sinovac hiện đang tiến thành một thử nghiệm của giai đoạn 2 đối với những người lớn tuổi và sẽ tiến hành một thử nghiệm nữa đối với trẻ em và thanh niên. Trước đó công ty đã sử dụng công nghệ này để tạo ra các vắc xin đã được phê duyệt để phòng bệnh viêm gan A, viêm gan B và cúm lợn, cúm gia cầm và virus gây bệnh chân tay miệng.
Moderna/ NIAID
Vắc xin ứng viên có tên mRNA-1273 do công ty công nghệ sinh học Moderna của Mỹ và Viện quốc gia các bệnh dị ứng và truyền nhiễm (NIAID) phối hợp phát triển. Vắc xin này là vắc xin đầu tiên được thử nghiệm trên người ở Mỹ.
Vắc xin của Moderna dựa vào một công nghệ chưa từng được sử dụng trong bất kỳ vắc xin nào đã được phê duyệt từ trước tới nay: đó là một mẩu vật liệu di truyền được gọi là RNA thông tin (mRNA).
Các vắc xin thông thường được tạo ra từ virus yếu hoặc khử hoạt tính, hoặc từ protein của các virus này, để tạo ra phản ứng miễn dịch. Các vắc xin mRNA lại được tạo ra từ vật liệu di truyền “dạy” cho tế bào cách tự tạo ra các protein virus này (trong trường hợp này là protein dằm của virus corona).
Cả hai loại vắc xin đều thúc đẩy sinh ra phản ứng miễn dịch trong cơ thể để nếu một người vô tình phơi nhiễm với virus thì cơ thể người đó sẽ nhanh chóng nhận ra và chống lại virus.
Những vắc xin mRNA này có một số ưu điểm, trong đó có ưu điểm sản xuất nhanh hơn và dễ hơn các loại vắc xin truyền thống vốn mất thời gian phát triển do các nhà khoa học phải nuôi trồng và khử hoạt tính của toàn bộ mầm bệnh hoặc của các protein của mầm bệnh.
Vắc xin mRNA cũng có thể có kháng mầm bệnh đột biến được hiệu quả hơn, ví dụ như mầm bệnh là virus corona và virus cúm. Tuy nhiên, vắc xin mRNA có thể gây ra phản ứng có hại cho cơ thể. Loại vắc xin này cũng có một số vấn đề về tính ổn định, phá vỡ rất nhanh, nên có thể hạn chế sức mạnh miễn dịch.
Các vắc xin mRNA đã được chứng minh là “lựa chọn đầy hứa hẹn” trước các vắc xin truyền thống, nhưng “ứng dụng của các vắc xin này cho đến nay vẫn bị cấm do tính không ổn định và không hiệu quả” trên cơ thể người.
Các tiến bộ công nghệ ngày nay đã khắc phục được phần lớn những vấn đề đó, và nhiều vắc xin mRNA đang có tiềm năng bảo vệ cả động vật và con người khỏi các bệnh truyền nhiễm cũng như một số loại bệnh ung thư - đây là nhận xét của một nhóm các nhà nghiên cứu đăng trên tập san Nature Reviews Drug Discovery vào năm 2018.
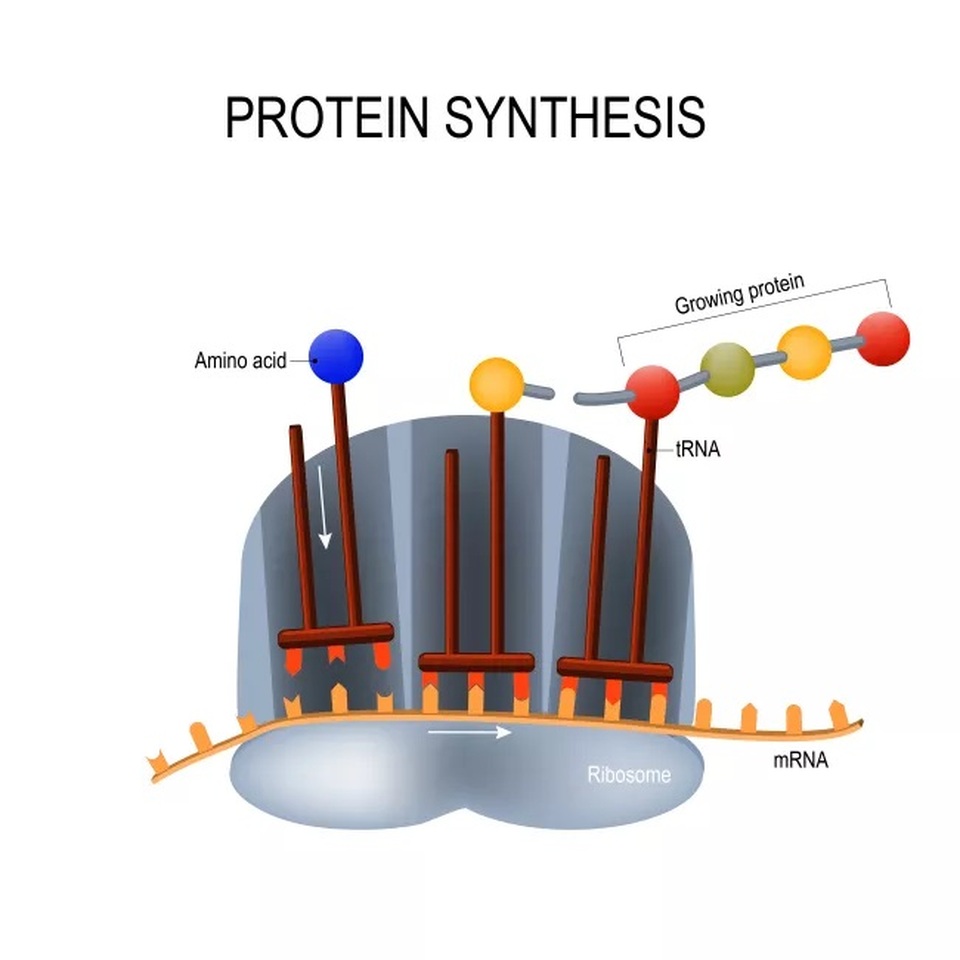
Các vắc xin mRNA hướng dẫn cho tế bào cách tạo ra protein dằm (mRNA được dịch mã thành các axid amin, thành phần cơ bản của các protein bên trong ribosome của tế bào).
Ngày 14/7/2020, Moderna đã công bố các kết quả ban đầu rất khả quan của thử nghiệm giai đoạn một được tiến hành đối với 45 người tình nguyện. Những người này được chia làm ba nhóm được tiêm các liều vắc xin thấp, trung bình và cao. Sau hai lần tiêm, cả ba nhóm đều sinh ra kháng thể trung hòa ở các mức trên trung bình so với những bệnh nhân Covid-19 đã khỏi bệnh.
Vắc xin này cho đến nay vẫn an toàn và được dung nạp tốt, nhưng hơn một nửa số người tham gia thí nghiệm đã có một số phản ứng phụ (tương tự như những tác dụng phụ có thể xảy ra do tiêm phòng cúm mùa) như là mệt mỏi, ớn lạnh, đau đầu, đau cơ, đau tại vết tiêm.
Một số người ở nhóm tiêm liều trung bình và cao bị sốt sau mũi tiêm thứ hai. Một người tiêm liều cao bị sốt cao, chóng mặt, xây xẩm và mất nhận thức trong một thời gian ngắn, nhưng sau 1 ngày rưỡi thì hồi phục dần. Liều cao như vậy sẽ không được áp dụng cho những người tham gia thí nghiệm tới đây.
Moderna vẫn đang tiếp tục tiến hành giai đoạn thử nghiệm thứ hai. Vào ngày 27/7 vừa qua, công ty bắt đầu thử nghiệm giai đoạn 3 ở Mỹ. Lần thử nghiệm này sẽ có khoảng 30.000 người tham gia từ nay đến cuối mùa hè, và kết quả đầu tiên dự kiến sẽ được công bố vào tháng 11.
Vào tháng 4/2020, HHS cam kết sẽ dành 483 triệu đô-la Mỹ để đẩy nhanh quá trình phát triển vắc xin này của Moderna.
Ngày 28/7/2020, các nhà khoa học đã công bố trên Tập san Y khoa New England kết quả thử nghiệm vắc xin của Moderna trên khỉ vàng. Sau khi được tiêm vắc xin 2 lần với liều lượng 10 hoặc 100 μg cách nhau 2 tuần, những con khỉ này được cho phơi nhiễm với virus corona ở tuần thứ 8.
Các nhà nghiên cứu nhận thấy chúng phát triển phản ứng miễn dịch rất khỏe, hệ miễn dịch của chúng sản xuất ra cả kháng thể trung hòa và tế bào T. Hai ngày sau khi phơi nhiễm, các nhà nghiên cứu không thể phát hiện ra bất cứ sự nhân bản nào của virus trong mũi hoặc phổi của khỉ. Điều đó cho thấy vắc xin đã bảo vệ được chúng. (Kết quả này ngược lại so với nghiên cứu của Trường đại học Oxford cũng tiến hành trên khỉ nhưng chỉ bảo vệ được chúng không bị bệnh phổi, còn vẫn bị nhiễm virus corona mới.)
CanSino Biologics/Viện Công nghệ Sinh học Bắc Kinh
Công ty chuyên sản xuất vắc xin của Trung Quốc CanSino Biologics đã phối hợp với Viện Công nghệ Sinh học Bắc Kinh phát triển một vắc xin ứng viên sử dụng virus adeno đã được làm yếu. Không giống như vắc xin Oxford dựa vào một virus adeno lây nhiễm trên tinh tinh, vắc xin của CanSino Biologics sử dụng virus adeno tấn công con người.
Cùng với Moderna của Mỹ, nhóm nghiên cứu của Trung Quốc cũng đã công bố các kết quả của thử nghiệm giai đoạn hai vào ngày 20/7/2020. Thử nghiệm này được tiến hành ở Vũ Hán với 508 người tham gia. Những người này được chọn ngẫu nhiên tiêm một hoặc 2 liều vắc xin khác nhau hoặc một giả dược.
Nghiên cứu này cũng không tìm ra tác dụng phụ nghiêm trọng, mặc dù một số người có phản ứng nhẹ hoặc trung bình như là sốt, mệt mỏi và đau ở vùng tiêm. Khoảng 90% những người tham gia đã phát triển phản ứng tế bào T và khoảng 85% phát triển kháng thể trung hòa.
Đại diện của Trung tâm Đánh giá vắc xin quốc tế John Hopkin của Mỹ cho biết kết quả của cả hai nghiên cứu này (ở Oxford và Vũ Hán) đều khá giống nhau và đáp ứng tốt để tiến hành các thử nghiệm giai đoạn ba, khi đó các vắc xin phải được thí nghiệm trên nhiều người hơn để đánh giá hiệu lực và độ an toàn.
Công ty đang có kế hoạch tiến hành thử nghiệm giai đoạn ba ở ngoài Trung Quốc.
Sinopharm
Tập đoàn sở hữu nhà nước Dược phẩm quốc gia Trung Quốc (Sinopharm) cũng đang phát triển một vắc xin ứng viên dựa trên virus SARS-CoV-2 bị khử hoạt tính.
Ngày 13/8/2020, công ty này đã công bố dữ liệu của các thử nghiệm lâm sàng giai đoạn một và hai. Trong giai đoạn một, 96 người lớn khỏe mạnh đã sử dụng ngẫu nhiên một liều vắc xin thấp, trung bình hoặc cao, hoặc giả dược là aluminum hydroxide, liều thứ hai và ba sau 28 ngày và 56 ngày.
Các nhà nghiên cứu nhận thấy vắc xin đã thúc đẩy cơ thể sinh ra kháng thể trung hòa. Ở những người sử dụng giả dược, 12,5% có phản ứng phụ. Ở những người sử dụng liều vắc xin thấp, trung bình hoặc cao thì lần lượt 20,8%, 16.7% và 25% có phản ứng phụ nhẹ.
Trong thử nghiệm giai đoạn 2, 224 người lớn được tiêm liều trung bình hoặc giả dược và tiêm lần thứ hai sau 14 hoặc 21 ngày. Những người này cũng phát triển kháng thể trung hòa và một số người có phản ứng phụ nhẹ. Phản ứng phụ phổ biến là đau ở vùng tiêm và sau đó sốt nhẹ, nhưng không ai có phản ứng nghiêm trọng.
Công ty đã bắt đầu thử nghiệm giai đoạn ba ở Abu Dhabi và sẽ thu nhận 15.000 người tham gia. Những người này sẽ được tiêm 1 hoặc 2 liều vắc xin hoặc giả dược.
Pfizer/BioNTech/Fosun Pharmaceutical
Cũng giống như Moderna, hãng Pfizer và công ty công nghệ sinh học Đức (BioNTech) đang phát triển một vắc xin sử dụng RNA thông tin để tạo cho hệ miễn dịch biết cách nhận ra virus corona.
Kết quả ban đầu của thử nghiệm giai đoạn một và hai cho thấy vắc xin này không gây ra bất cứ tác dụng phụ nghiêm trọng nào và có thể thúc đẩy phản ứng miễn dịch. Dữ liệu của hai đợt thử nghiệm đã được công bố vào ngày 1/7/2020 nhưng chưa được cộng đồng khoa học đánh giá. Nghiên cứu này có sự tham gia của 45 bệnh nhân.
Họ được tiêm một trong ba liều hoặc vắc xin ứng viên hoặc giả dược. Không ai có phản ứng phụ nghiêm trọng, nhưng một số người bị sốt (chiếm 75% số người tiêm liều cao nhất), mệt mỏi, đau đầu, ớn lạnh, đau cơ, đau khớp.
Các nhà nghiên cứu nhận thấy vắc xin này đã kích thích hệ miễn dịch tạo ra kháng thể trung hòa ở mức cao hơn 1,8 đến 2,8 lần so với kháng thể ở bệnh nhân hồi phục. Sau đó Pfizer đã công bố những kết quả mới cho thấy vắc xin này cũng thúc đẩy sinh ra tế bào T đặc hiệu với virus corona mới.
Trong tuần này, chính quyền của Tổng thống Mỹ Donald Trump đã công bố một hợp đồng trị giá 1,95 tỷ đô-la Mỹ với Pfizer và BioNTech để sản xuất ít nhất 100 triệu liều vắc xin vào cuối năm nay nếu vắc xin này được chứng minh là an toàn và hiệu quả.
Người Mỹ sẽ được tiêm miễn phí vắc xin. Trước đó, hai công ty này đã công bố một hợp đồng với Anh để sản xuất 30 triệu liều vắc xin ứng viên nếu vắc xin này có tác dụng và được phê duyệt. Pfizer đang lên kế hoạch trong tháng này bắt đầu thử nghiệm giai đoạn ba trên quy mô lớn và đánh giá kết quả vào đầu tháng 10.
Johnson & Johnson's Janssen
Vắc xin ứng viên phòng Covid-19 của Johnson & Johnson's Janssen được đặt tên là Ad26, cũng đang được phát triển từ virus adeno yếu. Loại vắc xin này được gọi là vắc xin vector vì nó sử dụng một virus đã bị làm yếu đi làm phương tiện (vector) truyền thông tin về mầm bệnh cho cơ thể biết để từ đó cơ thể sinh ra phản ứng miễn dịch. Trong trường hợp này virus adeno yếu truyền tải protein dằm của SARS-CoV-2. Hãng Janssen đã từng sử dụng công nghệ này để phát triển vắc xin Ebola.
Ngày 30/7/2020, các nhà nghiên cứu công bố rằng một mũi tiêm duy nhất vắc xin Ad26 đã bảo vệ được khỉ vàng khỏi bị nhiễm virus corona mới. Trong nghiên cứu này, các nhà khoa học đã thí nghiệm bảy loại hơi khác nhau một chút của vắc xin Ad26 và xác định được một loại sản xuất ra nhiều kháng thể trung hòa nhất.
Sau khi được tiêm các loại khác nhau của Ad26, những con khỉ vàng thí nghiệm được cho phơi nhiễm với virus. Sáu trong số bảy con được tiêm loại vắc xin biến thể có tên riêng Ad26.COV2.S (trong số bảy loại) và sau đó các nhà nghiên cứu không phát hiện ra virus trong đường hô hấp dưới của chúng. Chỉ có một có có tải lượng virus rất thấp ở mũi.
Hiện nay, hãng này đang tiến hành thử nghiệm lâm sàng giai đoạn một và giai đoạn 2a ở Mỹ và Bỉ với vắc xin Ad26.COV2.S. Dự kiến sẽ có 1.045 người khỏe mạnh trong độ tuổi từ 18 đến 55 và trên 65 sẽ tham gia thí nghiệm để kiểm tra mức độ an toàn, tác dụng phụ và phản ứng miễn dịch. Các nhà nghiên cứu cũng sẽ kiểm tra các quy trình và liều lượng khác nhau.
Hãng cũng lên kế hoạch tiến hành một thử nghiệm giai đoạn một ở Nhật Bản và giai đoạn hai ở Hà Lan, Tây Ban Nha và Đức. Nếu vắc xin này đạt yêu cầu về an toàn và hiệu quả qua các lần thử nghiệm đó, các nhà nghiên cứu sẽ bắt đầu giai đoạn ba vào tháng 9 với khoảng 60.000 người tham gia ở nhiều nước trên thế giới.
Hãng Johnson & Johnson mới công bố một hợp đồng với chính phủ Mỹ, trị giá 1 tỷ đô-la Mỹ để sản xuất 100 triệu liều vắc xin nếu vắc xin được phê duyệt hoặc được FDA cấp phép sử dụng trong trường hợp khẩn cấp.










